الکل در شیمی
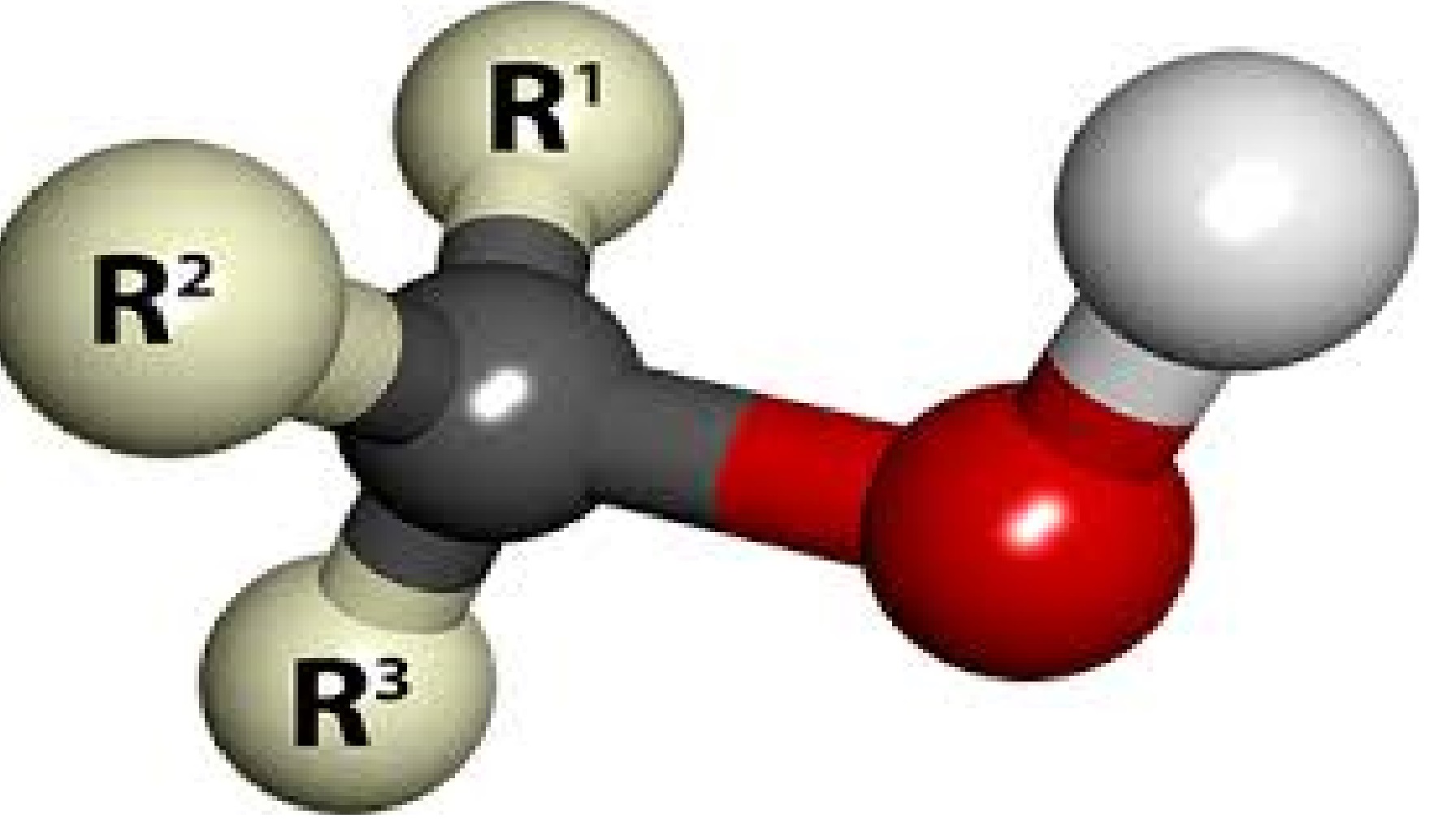
در شیمی به هر ترکیب شیمیایی که یک گروهِ هیدرکسیل (-OH) متصل به کربن یک آلکیل داشتهباشد، الکل گویند. فرمول کلی یک الکل سادهٔ غیر حلقهای CnH2n+1OH است. در شیمی الکلها در شمار گروه مهمی از ترکیبهای شیمیایی هستند و در واکنشهای گستردهای شرکت میکنند و بسیاری از ترکیبهای شیمیایی از آنها به دست میآیند، بهطوری در کتاب شیمی آلی موریسن و بوید آمدهاست که اگر به شیمیدانی بگویند او را با ده ترکیب شیمیایی در یک جزیره تنها خواهند گذاشت الکل یکی از آنها خواهدبود. بیشتر خانوادههای الکل پسوند (ول) میگیرند مانند بوتانول، اتانول
بهطور کلی، زمانی که نام الکل به تنهایی به کار میرود، معمولاً منظور اتانول است که همان الکل گرفتهشده از جو یا عرق یا همان مشروبات الکلی میباشد. اتانول مایعی بیرنگ و فرار وبا بویی بسیار تند است که از تخمیر شکرها به دست میآید. همچنین گاه به هر گونه نوشیدنی که الکل داشتهباشد، الکل میگویند. هزاران سال است که معمولاً الکل به عنوان یکی از عاملهای اعتیادآور بهشمار میآید.
الکلهای دیگر بیشتر با صفتهای مشخصکنندهٔ ویژهٔ خود میآیند مانند الکل چوب (که همان متانول است) یا ایزوپروپیل الکل. پسوند «ول» نیز در پایان نام شیمیایی همهٔ الکلها میآید. با فرمول شیمیایی C2H5OH
آنچه خواهید خواند
Toggleتاریخچه
محمد بن زکریا رازی در آثار خود به فرآیندهای تقطیر مواد مختلف اشاره کرده است. او احتمالاً الکل (اتانول) را از طریق تقطیر شراب جدا کرده و از آن بهعنوان حلال یا مادهای با کاربرد پزشکی استفاده کرده است. با این حال، دانش تقطیر پیش از رازی، از جمله توسط جابر بن حیان در قرن هشتم میلادی، شناخته شده بود و تولید مواد الکلی در تمدنهای دیگر نیز سابقه داشت و برخلاف تصورات رایج، رازی الکل را کشف نکرد، بلکه به توسعه روشهای تقطیر و کاربردهای پزشکی آن کمک نمود .
ساختار و دستهبندی
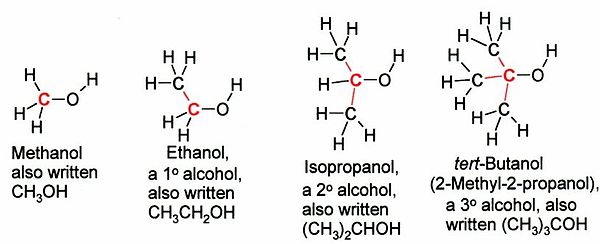
الکلها بسته به نوع کربنتکه به گروه OH- پیوند دارد به سه دسته نوع اول، نوع دوم یا نوع سوم طبقهبندی میشوند:
نمایش کلی انواع الکل
- الکل نوع اول CR(H)۲-OH:اگر به کربن متصل به گروه OHOH، تنها یک گروه آلکیل متصل باشد، به آن الکل نوع اول یا الکل نوع ۱ میگویند. نمونههایی از الکل نوع اول در زیر آورده شده است:
- الکل نوع دوم C(R)۲H-OH:در حالتی که دو گروه آلکیل به اتم متصل به گروه هیدروکسیل وصل شده باشند، به آن الکل نوع دوم گفته میشود
- الکل نوع سومC(R)۳-OH: با توجه به ترتیب ذکر شده، اگر گروههای متصل به کربن دارای سه گروه باشند، الکل مورد نظر، از نوع سوم است که نمونههایی از آن را در تصویر زیر میبینید
انواع الکل و کاربردها
الکلها از گذشته کاربردهای زیادی داشتهاند که در زیر به بخشی از آنها اشاره میکنیم:
متانول: برای تهیه فرمالدهید و مکملهای سوخت
اتانول: در مکملهای سوخت و استریلیزه کردن وسایل بیمارستانی
۱-پروپانول، ۱-بوتانول و ایزو بوتیل: برای استفاده با کاربرد حلال و ماده اولیه حلالها
الکلهای C_6 تا C-11: به منظور زیاد کردن خاصیت پلاستیکی یا کاهش ویسکوزیته مواد
الکلهای چرب: با کاربرد ماده اولیه مواد شوینده و ارایشی بهداشتی
حلالیت
تعداد گروه های هیدروکسیلی که در ساختار ماده وجود دارد می تواند بر انحلال پذیری آن تاثیر داشته باشد.
با افزایش تعداد گروه های هیدروکسیلی بر روی مولکول انحلال پذیری ماده در آب افزایش می یابد. به عنوان مثال 1و4 بوتان دی ال (دارای دو گروه هیدروکسیل) انحلال پذیری ای بالا تر از 1-بوتانول (دارای یک گروه هیدروکسیل) در آب دارد.
علاوه بر این، هرچه گروه های کربن موجود در الکل بیشتر باشد، انحلال پذیری آن در آب نیز کاهش می یابد بنابراین 1-اکتانول با 8 اتم کربن انحلال پذیری کمتری نسبت به 1-بوتانول با چهار اتم کربن دارد.
معمولا در صورتی که تعداد کربن این ترکیبات 4 اتم بیشتر باشد معمولا انحلال پذیری کمتر می شود. تا جایی که در صورت مخلوط نمودن دو الکل با داشتن اتم های کربن بیشتر از 4 می توان شاهد دو فازی شدن محلول بود.
با توجه به ین که پیوند بین الکلها مانند آب، پیوند هیدروژنی است بنمودر اندازهای در آب حل میشود. همچنین با توجه به این که الکلها از یک سو بخشی آلی داشته و از سوی دیگر گروه هیدروکسیل دارند بسیاری از مواد آلی را نیز حل میکنند. دومین حلال بعد از آب است که برخی از مواد شیمیایی در آن حل میکنند.
محلول ید در محلول آب و الکل را تنتور ید میگویند و برای گندزدایی به کار میروند.
الکل اسید است یا باز
الکلها مقداری خاصیت اسیدی از خود نشان می دهند. درواقع الکترونگاتیوی به نسبت بالای اکسیژن موجب افزایش خاصیت اسیدی آن شده است. در الکلها پروتون به اکسیژن متصل شده است. پس از حذف پروتون در یون آلکوکسید، بار منفی ایجاد شده توسط این الکترونگاتیوی بالا پایدار می گردد. pKa که کمیتی برای بیان میزان اسیدیته است، برای متانول ۵/۱۵ و برای اتانول ۹/۱۵ است. توجه شود که هر چه pKa بیشتر باشد، اسید ضعیف تر خواهد بود.
الکلها در مجموع دارای pKa برابر با ۱۶ تا ۱۹ هستند. این ترکیبات به طور کلی اسیدهایی ضعیفی بوده و نمکهایی موسوم به آلکوکسید در واکنش با بازهای قوی همچون سدیم هیدرید تشکیل میدهند
الکلها قطبی هستند یا غیر قطبی
گروه هیدروکسیل موجود در ترکیبات الکلی موجب قطبی شدن الکلها می شود. این گروهها با خود و سایر ترکیبات پیوندهای هیدروژنی تشکیل می دهند. حضور گروه OH در این ترکیبات موجب شده تا نسبت به سایر هیدروکربن ها حلال پذیری بیشتری در آب داشته باشند. متانول، اتانول و پروپانول الکلهای کوچکی بوده و در آب امتزاج پذیرند. بوتانول نیز با چهار اتم کربن تقریبا با آب امتزاجپذیر است.
پیوند هیدروژنی الکلها موجب شده است تا این ترکیبات نسبت به هیدروکربنها و اترها نقطه جوش بالاتری داشته باشند.
الکل در شیمی

دیدگاهتان را بنویسید
برای نوشتن دیدگاه باید وارد بشوید.